

发布时间:2025-04-14

编者按
帕金森病(Parkinson's disease, PD)是一种常见的神经退行性疾病,其特征是中脑黑质多巴胺能神经元的退化。近年来的研究表明,外周免疫细胞(如T细胞)能够穿过血脑屏障(BBB)进入中枢神经系统(CNS),并与脑内驻留细胞相互作用,从而可能参与PD的发病机制。然而,T细胞与脑细胞之间的通信机制尚未完全阐明,且缺乏能够研究T细胞与脑内细胞相互作用的模型。
今天,我们分享一项2025年2月28日由德国埃尔朗根-纽伦堡大学医院Iryna Prots研究团队发表在《NPJ Parkinson's Disease》上的最新研究成果——Novel co-culture model of T cells and midbrain organoids for investigating neurodegeneration in Parkinson’s disease。该研究开发了一种三维(3D)共培养模型,通过将干细胞衍生的人类中脑类器官(hMO)与外周血T细胞结合,模拟T细胞与中脑组织的相互作用,为研究PD的神经免疫机制提供新的工具,有助于深入理解T细胞在PD中的作用,并为未来的帕金森病(PD)治疗策略提供了理论基础。
文章题目
Novel co-culture model of T cells and midbrain organoids for investigating neurodegeneration in Parkinson’s disease
杂志:NPJ Parkinson's Disease(IF=6.7,中科院一区,帕金森病专业领域影响因子排名第一)
发表时间:2025年2月28日
作者:Iryna Prots研究团队等
单位:德国埃尔朗根-纽伦堡大学等
01、研究亮点
1. 创新性地构建了三维共培养模型,模拟帕金森病病理过程:研究团队首次将人类中脑类器官(hMO)与外周血T细胞结合,建立三维(3D)共培养体系,可以有效模拟帕金森病(PD)中血脑屏障破坏后T细胞浸润中枢神经系统的病理过程;
2. 揭示T细胞浸润导致神经元损伤的机制:激活的T细胞高表达LFA-1和VLA-4整合素,与类器官中的配体(ICAM-1和VCAM-1)结合,促进T细胞浸润。这一发现解释了帕金森病中神经退行性病变的部分机制,为开发针对神经炎症的干预策略提供了理论依据。
3. 发现年龄与脑区特异性对T细胞敏感性的影响:60天的中脑类器官比30天的更易受T细胞攻击,提示年龄相关的神经退行性疾病,如帕金森病中,衰老神经元对免疫攻击的敏感性更高。
4. 提供帕金森病研究的新工具:为探索T细胞与大脑细胞相互作用机制提供了新工具,为帕金森病免疫治疗策略提供了一个有前景的平台。

图1 研究模式图
02、研究背景
帕金森病(Parkinson’s disease,PD)是一种常见的神经退行性疾病,全球患病人数众多,其主要病理特征为中脑黑质致密部多巴胺能神经元进行性变性死亡,导致纹状体多巴胺含量显著降低,进而引发运动症状,如震颤、肌强直、运动迟缓等,同时还伴有非运动症状,如认知障碍、睡眠障碍等。
目前,帕金森病的发病机制尚未完全明确,传统观点认为主要与遗传因素、环境因素、氧化应激、线粒体功能障碍等有关。近年来,免疫系统在帕金森病发病中的作用逐渐受到关注,神经炎症被认为是帕金森病进展的重要因素之一,T细胞作为免疫系统的关键组成部分,可能在其中发挥重要作用。
在帕金森病患者体内,血脑屏障的完整性遭到破坏,就像一道原本坚固的城墙出现了缺口,使得外周免疫细胞,尤其是T细胞,能够侵入大脑。大量研究表明,T细胞的浸润与帕金森病的发生和病情恶化密切相关。然而,T细胞与大脑细胞的具体相互作用机制尚不清楚。
在这项研究中,研究团队开发了一种三维共培养模型,将人类中脑类器官(hMO)与外周血T细胞结合。研究人员首先从健康供体的成纤维细胞入手,将其转化为诱导多能干细胞(hiPSC),并诱导分化为hMO。这些类器官稳定表达中脑特异性标记物,为深入研究帕金森病中T细胞与大脑细胞的相互作用提供了有力工具,并为未来治疗方法的开发提供了新方向。
研究结果表明,T细胞能够浸润hMO组织,并导致神经元细胞死亡和神经元丢失。此外,研究还发现,随着hMO的成熟(即从30天到60天),其对T细胞浸润的易感性增加,且中脑组织比皮质组织更容易受到T细胞浸润的影响。这些发现为理解T细胞在PD中的作用提供了新的视角,并为未来的治疗策略提供了潜在的靶点。
03、研究成果
1. 构建共培养模型并开展hMO特性研究
研究人员建立了T细胞与hMO的三维共培养模型,并诱导多种中脑特异性细胞分化形成hMO。在此期间,hMO不断发育成熟,细胞类型从以SOX2+神经祖细胞为主,逐渐转变为富含成熟的MAP2+神经元。hMO还稳定表达TH、FOXA2等中脑特异性标记物,为后续研究T细胞与中脑组织相互作用提供了极为可靠的细胞模型。
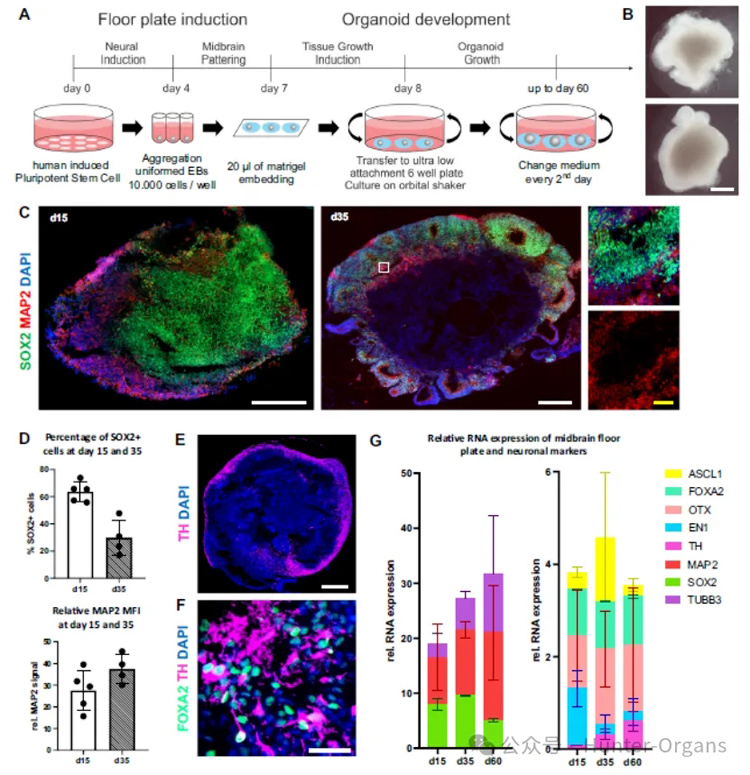
图2
2. T细胞的浸润及hMO的作用
通过优化T细胞与hMO的共培养条件,研究人员发现白细胞介素2(IL-2)对维持T细胞的活力和激活状态起着关键作用。激活后的T细胞能够浸润hMO组织,且浸润的T细胞高表达LFA-1和VLA-4整合素,而hMO组织中存在配体ICAM-1和VCAM-1,这表明这些分子介导了T细胞的浸润过程。
与未共培养的hMO相比,T细胞共培养的hMO中细胞死亡增加,MAP2神经元信号显著降低,且浸润的T细胞会释放颗粒酶B、CD107a等细胞毒性蛋白,同时还会分泌IFN-γ、TNF-α和IL-17等促炎细胞因子,这表明T细胞浸润导致了神经细胞死亡和神经元数量减少,揭示了T细胞对中脑类器官神经细胞具有损伤作用。
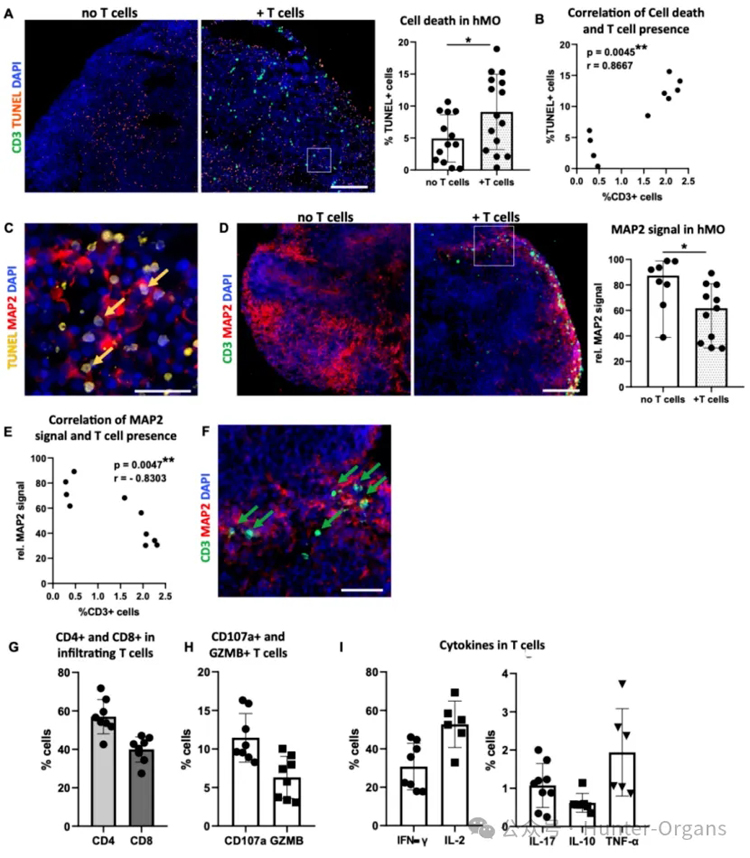
图3
3. hMO对T细胞的敏感性存在差异
60天的hMO比30天的hMO更容易受到T细胞的浸润 ,这表明帕金森病这类与年龄相关的神经退行性疾病,年龄的增长会增加中脑类器官对T细胞浸润的易感性;
区域特异性上看,hMO比人类大脑皮层类器官(hCO)对T细胞浸润更敏感,且T细胞浸润hCO后,细胞死亡和神经元丢失现象不明显,这表明不同脑区组织对T细胞的反应存在差异。
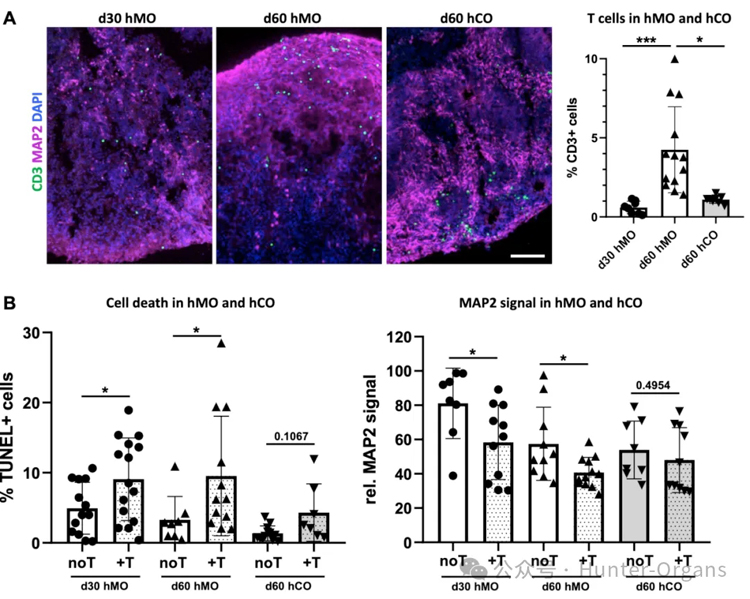
图4
04、编者点评
综上所述,该研究成功开发了一种由人类中脑类器官(hMO)和外周血T细胞组成的三维共培养模型,用于研究T细胞与中脑组织之间的相互作用及其在帕金森病(PD)中的潜在影响。该模型的建立不仅为研究T细胞与神经元之间的相互作用提供了一个强大的工具,而且也为研究其他神经退行性疾病中的免疫-神经相互作用提供了一个可扩展的平台。
作为健康美丽产业CRO服务开拓者与引领者、斑马鱼生物技术的全球领导者,环特生物搭建了“斑马鱼、类器官、哺乳动物、人体”多维生物技术服务体系,开展健康美丽CRO服务、科研服务、智慧实验室搭建三大业务。目前,环特已建立200多种斑马鱼模型,胃癌、脑类器官、心脏类器官及各种肿瘤类器官培养平台,欢迎有需要的读者垂询!